Atomspektrum

Irene Kramer-Schwenk
die Wellenlängen- bzw. Frequenzfolge, die durch die spektrale Zerlegung der von Atomen emittierten bzw. absorbierten elektromagnetischen Strahlung entsteht.
Die grundlegende Bedeutung der Analyse der Atomspektren für das Verständnis der Struktur der Atome formulierte Sommerfeld bereits 1919, also noch vor der Entwicklung der modernen Quantentheorie: "Seit der Entdeckung der Spektralanalyse konnte kein Kundiger zweifeln, dass das Problem des Atoms gelöst sein würde, wenn man gelernt hätte, die Sprache der Spektren zu verstehen. [...] Alle ganzzahligen Gesetze der Spektrallinien und der Atomistik fliessen letzten Endes aus der Quantentheorie. Sie ist das geheimnisvolle Organon, auf dem die Natur der Spektralmusik spielt und nach dessen Rhythmus sie den Bau der Atome und Kerne regelt."
Ein Atom emittiert elektromagnetische Strahlung, wenn die Atomhülle von einem angeregten Zustand in einen energetisch niedriger liegenden Zustand oder in den Grundzustand übergeht. Die gebräuchlichsten Arten atomarer Anregung sind:
1) Thermische Anregung im elektrischen Lichtbogen bei Temperaturen von 6000 bis 8000°C oder im elektrischen Funken bei Temperaturen von 10000 bis 20000°C.
2) Fluoreszenzanregung, vor allem Resonanzfluoreszenzanregung, durch die Einstrahlung von absorptionsfähigem Licht, z.B. Laserlicht.
3) Stossanregung durch Stösse mit Elektronen und anderen Atomen.
Bei verschieden starker Anregung entstehen unterschiedliche Spektren der gleichen Substanz: Im Lichtbogen erscheinen vorwiegend die Spektren der neutralen Atome, im Funkenspektrum hauptsächlich die Spektren ein- oder mehrfach ionisierter Atome. Man bezeichnet danach z.B. mit Fe I das Bogenspektrum des (neutralen) Eisenatoms; mit Fe II, III, ... die vom einfach, zweifach usw. ionisierten Eisenatom herrührenden Funkenspektren des Eisens. Es sind Funkenspektren bis zum Ionisationsgrad 20 und höher bekannt.
In den Frequenzen oder Wellenzahlen der Spektrallinien der Atome und Ionen lassen sich deutliche Gesetzmässigkeiten erkennen, die die energetische Struktur der Atomhülle widerspiegeln. Beim Vergleich verschiedener Spektren gilt der spektroskopische Verschiebungssatz: Jedes Spektrum eines Ions vom Ionisationsgrad n ist im wesentlichen analog gebaut wie das Spektrum des Ions vom Ionisationsgrad n + 1 des nächsten Elements im periodischen System mit um 1 höherer Ordnungszahl, da der Charakter jedes Spektrums weitgehend durch die Zahl der Valenzelektronen des Atoms oder Ions bestimmt wird.
In den Spektren der Atome mit bis zu vier Valenzelektronen sind die Linien vorwiegend in Serien angeordnet. An die stärkste Linie mit niedrigster Wellenzahl schliesst sich eine Folge von Linien mit wachsender Wellenzahl, aber abnehmender Intensität an, wobei der Wellenzahlabstand von Glied zu Glied kleiner wird. Diese Serie von Linien strebt einer echten Häufungsstelle am kurzwelligen Ende zu, der Seriengrenze. Jenseits der Seriengrenze liegt ein kontinuierliches Spektrum, das Seriengrenzkontinuum.
Einelektronenspektren: Die einfachste Struktur weisen die
Spektren des Wasserstoffs, des einfach ionisierten Heliums und der weiteren
Ionen mit nur einem einzigen Elektron auf, die weitgehend in den Röntgenbereich
fallen (Röntgenspektrum, Wasserstoffspektrum). Die Wellenzahlen lassen sich mit
grosser Genauigkeit durch die Balmer-Formel l-1 = RZ2(1/n2 - 1/m2) darstellen. Hierbei
bedeuten R die Rydberg-Konstante, Z die Ordnungszahl und n
und m ganze Zahlen 1, 2, 3,... Die Spektren der Einelektronensysteme
lassen sich auf der Grundlage des Bohrschen Atommodells (Bohrsche Theorie)
deuten, dem zufolge die Elektronen nur diskrete Energiewerte En,m annehmen können,
zwischen denen Übergänge unter Emission oder Absorption von Licht gemäss der
Bohrschen Frequenzbedingung En - Em = hn
möglich sind. Damit ergeben sich eine theoretische Ableitung der Balmer-Formel
und ein Wert für die Rydberg-Konstante, der zahlenmässig sehr gut mit dem
empirisch gefundenen übereinstimmt. Bereits vor der Formulierung des Bohrschen
Atommodells fand W. Ritz (1908), dass durch Addition und Subtraktion der
Wellenzahlen zweier Spektrallinien eines Atoms meist die Wellenzahl einer
weiteren Linie entsteht (Ritzsches Kombinationsprinzip). Die Grössen Tn = - En/(![]() c)
werden als spektroskopische Terme bezeichnet. Da die Energien En der gebundenen
Zustände negativ sind, sind die zugehörigen Terme positiv. Eine graphische
Darstellung der Energiezustände der Atome ist das Termschema, in dem die Terme
nach ihrer Grösse geordnet als horizontale Geraden aufgetragen sind (Abb. 1-3).
Die Vertikalabstände der Geraden geben direkt die Wellenzahlen l-1 der Spektrallinien
wieder. Der tiefste Term mit n = 1 ist der Grundterm des Atoms (oder
Ions), er hat den grössten Termwert. Für n
c)
werden als spektroskopische Terme bezeichnet. Da die Energien En der gebundenen
Zustände negativ sind, sind die zugehörigen Terme positiv. Eine graphische
Darstellung der Energiezustände der Atome ist das Termschema, in dem die Terme
nach ihrer Grösse geordnet als horizontale Geraden aufgetragen sind (Abb. 1-3).
Die Vertikalabstände der Geraden geben direkt die Wellenzahlen l-1 der Spektrallinien
wieder. Der tiefste Term mit n = 1 ist der Grundterm des Atoms (oder
Ions), er hat den grössten Termwert. Für n ![]() ¥ erreicht man die Termseriengrenze, die der
Energie Null entspricht. Erfolgt die Anregung des Elektrons durch Licht der
Frequenz n,
so wird die betreffende Linie absorbiert. Das Seriengrenzkontinuum entsteht
durch einen Übergang des Elektrons aus einem gebundenen Zustand En in einen Zustand,
bei dem es sich ausserhalb des Atomverbands mit zusätzlicher kinetischer Energie
bewegt.
¥ erreicht man die Termseriengrenze, die der
Energie Null entspricht. Erfolgt die Anregung des Elektrons durch Licht der
Frequenz n,
so wird die betreffende Linie absorbiert. Das Seriengrenzkontinuum entsteht
durch einen Übergang des Elektrons aus einem gebundenen Zustand En in einen Zustand,
bei dem es sich ausserhalb des Atomverbands mit zusätzlicher kinetischer Energie
bewegt.
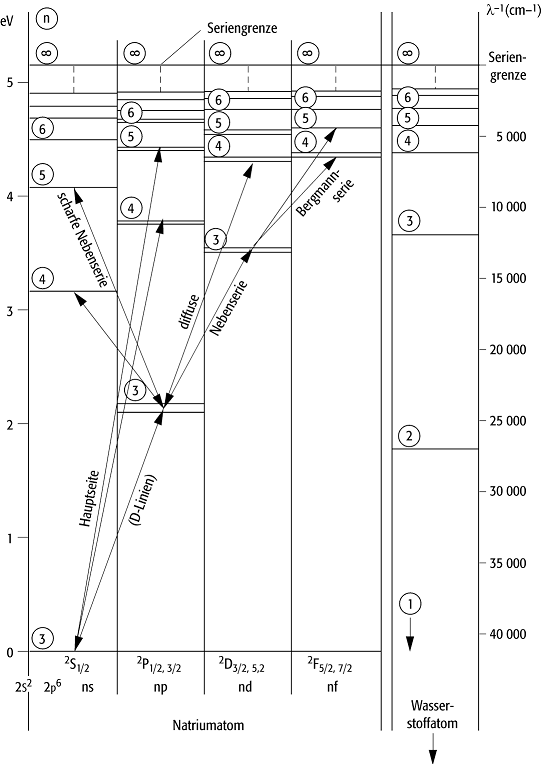
Spektren von Mehrelektronen-Atomen: Die Spektren der Atome oder Ionen mit mehreren Elektronen in der Hülle sind komplizierter als die Einelektronenspektren des Wasserstoffs und der wasserstoffähnlichen Ionen. Relativ einfach sind die Spektren der Atome oder Ionen mit nur einem Valenzelektron, bei denen also die Hülle ein Elektron zusätzlich zu einer Edelgaskonfiguration enthält: die Alkaliatome (Abb. 1), die einfach ionisierten Erdalkaliatome etc. Bei niedrigen Anregungsenergien bleibt der relativ stabile Atomrumpf mit seiner Edelgaskonfiguration praktisch unverändert, so dass sich nur die Zustände des Leuchtelektrons verändern, die aber dennoch eine grössere Mannigfaltigkeit als die nur durch n gekennzeichneten Zustände des Wasserstoffspektrums bilden. Die durch die Hauptquantenzahl n festgelegten Terme spalten in n verschiedene Unterniveaus auf. Empirisch lassen sich diese Serien durch die Formeln
![]()
(Rydberg-Formel,
a und b sind die
Rydberg-Korrekturen) oder
![]()
darstellen, wobei sn und sm Abschirmungskonstanten sind. Die allgemeinen Aussagen zum Wasserstoffspektrum (Kombinationsprinzip, Seriengrenze, Grenzkontinuum) bleiben voll gültig.
Im Rahmen der Quantenmechanik wird die Aufspaltung der n-Terme
durch die Berücksichtigung des Bahndrehimpulses l![]() des
Elektrons beschrieben. Für jedes n kann die Nebenquantenzahl l
die Werte l = n - 1, ..., 0 annehmen, und es gibt zu jedem Wert
von l eine besondere Termserie. Man bezeichnet die zu l = 0
gehörenden Terme mit dem Buchstaben s, zu l = 1 mit p, zu l = 2
mit d, zu l = 3 mit f usw. Die unter Lichtemission oder -absorption
erfolgenden Übergänge gehorchen der Auswahlregel Dl = ± 1. Es gibt folgende wichtige Serien:
1s
des
Elektrons beschrieben. Für jedes n kann die Nebenquantenzahl l
die Werte l = n - 1, ..., 0 annehmen, und es gibt zu jedem Wert
von l eine besondere Termserie. Man bezeichnet die zu l = 0
gehörenden Terme mit dem Buchstaben s, zu l = 1 mit p, zu l = 2
mit d, zu l = 3 mit f usw. Die unter Lichtemission oder -absorption
erfolgenden Übergänge gehorchen der Auswahlregel Dl = ± 1. Es gibt folgende wichtige Serien:
1s ![]() np ist die Hauptserie; 2p
np ist die Hauptserie; 2p
![]() ns ist die scharfe Nebenserie;
2p
ns ist die scharfe Nebenserie;
2p ![]() nd heisst diffuse Nebenserie; 3d
nd heisst diffuse Nebenserie; 3d ![]() nf ist die Fundamentalserie
(Bergmann-Serie).
nf ist die Fundamentalserie
(Bergmann-Serie).
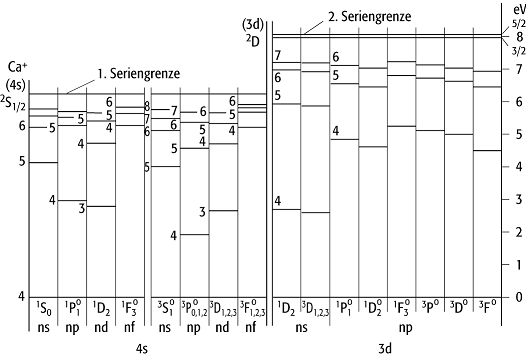
In den Spektren von Atomen oder Ionen mit zwei Valenzelektronen (z.B. beim Helium oder Calcium, Abb. 2) gibt es mehrere Seriengrenzen; auf die Tatsache, dass diese Atome auch mehrere Termsysteme aufweisen, wird weiter unten eingegangen. Die erste Seriengrenze entspricht der Abtrennung des einen Leuchtelektrons von einem alkaliähnlichen Ion im Grundzustand als Ionisationsprodukt. Höher liegende Seriengrenzen sind auf Doppelanregungen zurückzuführen: Ein Elektron geht in die nächst höhere Anregungsstufe, während das andere Elektron seine Serie von Anregungszuständen bis zur Seriengrenze durchläuft. Das Ionisationsprodukt ist jetzt ein Alkaliion in einem angeregten Zustand. Auf diese Weise entstehen diskrete Anregungszustände des Atoms jenseits der ersten Ionisationsgrenze (negative Terme). Ähnliche höhere Seriengrenzen gibt es auch in anderen Spektren. Tabelle 1 zeigt als weiteres Beispiel für Atome mit zwei Valenzelektronen die Termwerte des Quecksilberatoms.
Atomspektrum 1: Termwerte des Quecksilberatoms.
|
Singulett-Linien |
Triplett-Linien |
Interkombinations- |
|
1 184,96 nm |
1 546,07 nm |
1 253,65 nm |
|
2 1013,98 nm |
2 435,83 nm |
2 578,97 nm |
|
3 491,60 nm |
3 404,66 nm |
3 576,96 nm |
|
4 579,07 nm |
4 296,73 nm |
|
|
5 434,75 nm |
5 313,16 nm |
|
|
6 1691,83 nm |
6 312,57 nm |
|
|
|
7 366,29 nm |
|
|
|
8 365,48 nm |
|
|
|
9 365,01 nm |
|
Feinstruktur: Im allgemeinen sind die Atomspektren bedeutend komplizierter als bisher dargestellt; dazu tragen folgende Faktoren bei (Atomtheorie):
1) die Coulomb-Wechselwirkung der Elektronen;
2) relativistische Korrekturen;
3) quantenelektrodynamische Strahlungskorrekturen;
4) Wechselwirkungen der Elektronen mit den Freiheitsgraden des Atomkerns (Hyperfeinwechselwirkungen).
Die relativistischen Korrekturen führen gemeinsam mit
magnetischen Wechselwirkungen, die mit dem magnetischen Eigenmoment
(Spinmoment) der Elektronen verknüpft sind, zur Feinstruktur der Atomspektren
und umfassen bei einer Störungsrechnung erster Ordnung in ![]() 2/c2 hauptsächlich die
Spin-Bahn- und Spin-Spin-Wechselwirkungen. Der grösste Beitrag ist in der Regel
die Wechselwirkung zwischen Bahnmoment und Spin des selben Elektrons; dieser
Term ist in den meisten Fällen gemeint, wenn von Spin-Bahn-Kopplung gesprochen
wird. Für die schwersten Atome (etwa ab Rubidium) werden auch die anderen
relativistischen Effekte so gross, dass die Beiträge erster Ordnung oft nicht
mehr ausreichen oder eine Störungsrechnung sogar überhaupt nicht mehr anwendbar
ist. Die Berücksichtigung der endlichen Masse und Ausdehnung des Kerns sowie
der Wechselwirkung der Elektronen mit den elektrischen und magnetischen
Kernmomenten führt schliesslich zur Hyperfeinstruktur.
2/c2 hauptsächlich die
Spin-Bahn- und Spin-Spin-Wechselwirkungen. Der grösste Beitrag ist in der Regel
die Wechselwirkung zwischen Bahnmoment und Spin des selben Elektrons; dieser
Term ist in den meisten Fällen gemeint, wenn von Spin-Bahn-Kopplung gesprochen
wird. Für die schwersten Atome (etwa ab Rubidium) werden auch die anderen
relativistischen Effekte so gross, dass die Beiträge erster Ordnung oft nicht
mehr ausreichen oder eine Störungsrechnung sogar überhaupt nicht mehr anwendbar
ist. Die Berücksichtigung der endlichen Masse und Ausdehnung des Kerns sowie
der Wechselwirkung der Elektronen mit den elektrischen und magnetischen
Kernmomenten führt schliesslich zur Hyperfeinstruktur.
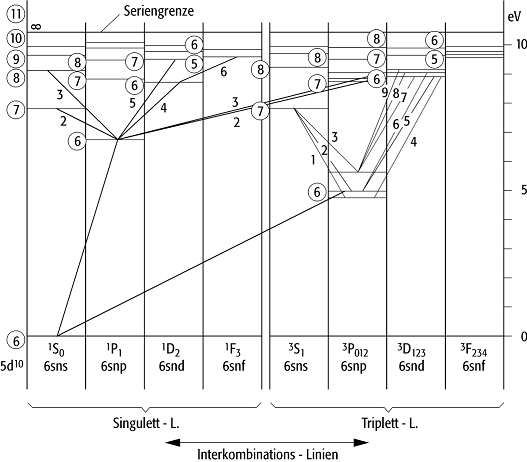
Die Feinstruktur äussert sich in der Multiplizität der Spektren. Bei den Spektren von Atomen mit einem Valenzelektron ausserhalb einer abgeschlossenen Schale, also den Alkalien, und auch bei solchen Elementen, bei denen ein Elektron zum Schalenabschluss fehlt, den Halogenen, sind bei entsprechender experimenteller Auflösung alle Einzellinien als eng beieinanderliegende Doppellinien zu erkennen; man spricht daher von Dublettspektren. Bei diesen Atomen sind alle Zustände mit l > 0 verdoppelt, es existiert genau ein Termsystem, das Dublettsystem. Bei den zweiwertigen Elementen, die entweder zwei Elektronen ausserhalb der Edelgasschale haben, den Erdalkalimetallen und Elementen der II. Nebengruppe, oder bei denen zwei Elektronen zu einer abgeschlossenen Schale fehlen, den Chalkogenen, gibt es zwei voneinander unabhängige Termsysteme: das Singulettsystem, das aus einfachen Zuständen besteht, und das Triplettsystem, das bei allen Zuständen ausser den s-Zuständen eine Feinstruktur von je drei Zuständen zeigt (Abb. 3).
Im Verlauf der Zunahme der Zahl der äusseren Elektronen der Elemente im Periodensystem findet man folgende, als Multiplizitäten bezeichnete Aufspaltungen der einzelnen Terme:
|
Zahl der Valenzelektronen |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Multiplizität |
2 |
1, 3 |
2, 4 |
1, 3, 5 |
2, 4 |
1, 3 |
2 |
1, 3 |
Es wechseln also geradzahlige und ungeradzahlige Multiplizitäten miteinander ab (spektroskopischer Wechselsatz). Mit Annäherung an eine Edelgasschale nehmen die auftretenden maximalen Multiplizitäten wieder ab.
Drehimpulskopplung und Termsymbolik: Im allgemeinen Fall, also bei mehr als einem Elektron, verwendet man zur Kennzeichnung der Feinstrukturniveaus und der zwischen ihnen auftretenden Strahlungsübergänge folgende drei Quantenzahlen: die Spinquantenzahl S des resultierenden Spindrehimpulses, die Drehimpulsquantenzahl L des resultierenden Bahndrehimpulses und die Gesamtdrehimpulsquantenzahl J.
Dies hat zur Voraussetzung, dass für die vektorielle Addition des Bahndrehimpulses und des Spins die sogenannte Russell-Saunders-Kopplung, auch LS-Kopplung genannt, gültig ist (Drehimpuls). Wie sich anhand experimenteller Untersuchungen zeigen lässt, trifft dies auf die meisten Atome - in Strenge allerdings nur für alle nicht zu schweren Atome - zu. Bei diesem Kopplungstyp ist die Wechselwirkung aller Bahndrehimpulse li der Elektronen und diejenige aller Spins si untereinander gross gegenüber der Wechselwirkung zwischen Bahndrehimpuls und Spin eines einzelnen Elektrons. So setzen sich zunächst die Bahndrehimpulse aller (äusseren) Elektronen zum resultierenden Bahndrehimpuls L, der den Termcharakter (Kennzeichnung mit Grossbuchstaben S, P, D, F etc.) bestimmt, zusammen, und die Spins der Elektronen addieren sich dazu analog zum Gesamtspin S der Atomhülle. L und S schliesslich addieren sich vektoriell zum Gesamtdrehimpuls J des Atoms.
Ein zweiter Drehimpulskopplungsytp, die sogenannte jj-Kopplung, tritt hauptsächlich bei den angeregten Zuständen schwerer Atome auf. Hier ist die Wechselwirkung zwischen Bahndrehimpuls und Spin der einzelnen Elektronen so gross, dass sich zunächst beide zu den Gesamtdrehimpulsen ji der Einzelelektronen zusammensetzen, die sich dann zum resultierenden Drehimpuls J des gesamten Atoms aufsummieren. Bei der jj-Kopplung gibt es also keinen Gesamt-Bahndrehimpuls L mehr, und damit entfällt auch die Möglichkeit, einen Term durch ein Symbol S, P, D, F, etc. zu kennzeichnen. LS- und jj-Kopplung führen zur gleichen Gesamtzahl der Feinstrukturterme, sie unterscheiden sich jedoch in der relativen Termlage. Im folgenden betrachten wir ausschliesslich den Fall der LS-Kopplung und erläutern die sogenannte Termsymbolik.
Für bestimmte Werte von L und S durchläuft J alle Werte von L + S bis L - S, wobei sich benachbarte Werte um 1 unterscheiden und zu verschiedenen Werten der Spin-Bahn-Wechselwirkungsenergie gehören. Für S £ L gibt es 2S + 1, sonst 2L + 1 verschiedene J-Werte; demgemäss wird (für L < S eigentlich unzutreffend) 2S + 1 allgemein als Multiplizität, mitunter auch als permanente Multiplizität bezeichnet. Im Singulettsystem ist S = 0, also J = L. Im Dublettsystem ist S = 1/2. Aus L und S bildet man dann die Werte
|
L = 0 |
1 |
2 |
3 |
4 |
usw. |
|
J = 1/2 |
1/2, 3/2; |
3/2,5/2; |
5/2, 7/2; |
7/2, 9/2; |
usw. |
Im Triplettsystem ist S = 1; hier gilt
|
L = 0 |
1 |
2 |
3 |
4 |
usw. |
|
J = 1 |
0,1,2 |
1,2,3 |
2,3,4 |
3,4,5 |
usw. |
Im Termsymbol wird die Multiplizität 2S + 1 oben links, der Wert von J unten rechts an die den verschiedenen L-Werten L = 0, 1, 2, ... zugeordneten Buchstaben S, P, D, angeschrieben, also z.B. 3D2 für S = 1, L = 2, J = 2.
Die magnetische Wechselwirkungsenergie bei einem Elektron ist proportional zu l s, bei mehreren Elektronen proportional zu
![]() .
.
Dabei ergibt sich diese Darstellung für L
S durch die Quantenzahlen J, L und S
aus J2 = (L + S)2, J2 = ![]() J(J +
1) und entsprechenden Gleichungen für L2 und S2.
Da L und S konstante Werte haben, sind die Energiedifferenzen
innerhalb des Multipletts proportional zu den Differenzen von J(J +
1). Für energetisch benachbarte Zustände ist DJ = 1, also D[J(J +
1)] = J(J +
1) - (J
- 1)(J
- 1
+ 1) = 2J
Daraus folgt die Landésche Intervallregel: Die Energie- bzw. Wellenzahlabstände
benachbarter Terme eines Termmultipletts sind proportional zur grösseren der
beiden Quantenzahlen J.
J(J +
1) und entsprechenden Gleichungen für L2 und S2.
Da L und S konstante Werte haben, sind die Energiedifferenzen
innerhalb des Multipletts proportional zu den Differenzen von J(J +
1). Für energetisch benachbarte Zustände ist DJ = 1, also D[J(J +
1)] = J(J +
1) - (J
- 1)(J
- 1
+ 1) = 2J
Daraus folgt die Landésche Intervallregel: Die Energie- bzw. Wellenzahlabstände
benachbarter Terme eines Termmultipletts sind proportional zur grösseren der
beiden Quantenzahlen J.
Für die Reihenfolge der Feinstrukturterme gilt: Im allgemeinen liegt die Energie mit dem niedrigsten J am tiefsten (grösste Ablösungsarbeit des Elektrons). Dies bezeichnet man als normale Termordnung. Die umgekehrte Ordnung tritt bei Termstörungen auf oder wenn statt 1, 2, ... Elektronen ebensoviele Löcher in abgeschlossenen Edelgasschalen die Termstruktur bedingen (z.B. Halogene und Chalkogene).
Über die Lage von Termgruppen gibt die Hundsche Regel Auskunft: Von den möglichen Multiplizitäten (Singuletts, Tripletts, u.a.) einer Elektronenkonfiguration liegt die Gruppe der höchsten Multiplizität am tiefsten; von den verschiedenen möglichen L-Zuständen liegen die mit dem grössten L am tiefsten.
Von besonderem Interesse ist der Grundzustand des Atoms. Die spektroskopisch nachgewiesenen Grundzustände der ersten Elemente des Periodensystems zeigt Tabelle 2.
Atomspektrum
2:
Spektroskopisch nachgewiesene Grundzustände der ersten Elemente des
Periodensystems.
|
Ordnungszahl Z |
Symbol des Elementes |
Grundzustand |
|
1 |
H |
1s1/2 |
|
2 |
He |
1s0 |
|
3 |
Li |
2s1/2 |
|
4 |
Be |
1s0 |
|
5 |
B |
2p1/2 |
|
6 |
C |
3p0 |
|
7 |
N |
4s3/2 |
|
8 |
O |
3p2 |
|
9 |
F |
3p3/2 |
|
10 |
Ne |
1s0 |
Auswahlregeln:
Bereits bei den einfachen Spektren eines einzigen Leuchtelektrons wird die
Gesamtheit der Spektrallinien durch die atomaren Energieniveaus und die
gültigen Auswahlregeln für Strahlungsübergänge bestimmt, durch die eine
Vielzahl von energetisch durchaus möglichen Übergängen verboten werden. Diese
Verbote folgen aus weiteren Erhaltungssätzen, nämlich für Gesamtdrehimpuls und
Parität des Systems einschliesslich des emittierten oder absorbierten Photons.
Angeregte Zustände, die aufgrund der Auswahlregeln weder direkt noch indirekt
mit dem Grundzustand kombinieren, werden als metastabile Zustände bezeichnet.
Für die elektrische Dipolstrahlung, dem bei atomaren und molekularen Systemen
(im Gegensatz zu Atomkernen) allein wesentliche Strahlungstyp, lauten die
Auswahlregeln:
1) Für
erlaubte Übergänge ist die Differenz DJ
zwischen den Drehimpulsquantenzahlen der beiden miteinander kombinierenden
Zustände 0, + 1 oder -
1, wobei Übergänge zwischen zwei Zuständen mit J = 0 verboten sind.
2) Für erlaubte Übergänge müssen die miteinander
kombinierenden Atomzustände verschiedene Parität haben (Laportesche
Auswahlregel). Die Parität bei einem einzelnen Elektron wird durch seinen
Bahndrehimpuls l bestimmt; sie ist gerade, falls l gerade ist, und ungerade,
falls l ungerade ist. Entsprechend bestimmt L die Parität des Gesamtzustandes
der Elektronenhülle. Zur Kennzeichnung der Parität setzt man bei ungeraden
Termen ein kleines o (von engl. odd "ungerade") oben rechts an das
Termsymbol, z.B. ![]() , während die
geraden Terme nicht extra gekennzeichnet werden.
, während die
geraden Terme nicht extra gekennzeichnet werden.
3) Das Umklappen eines Elektronenspins ist, auch bei
Änderung der übrigen Quantenzahlen, sehr unwahrscheinlich. Dies führt zum
Interkombinationsverbot, dem zufolge Übergänge zwischen Termsystemen
verschiedener Multiplizitäten verboten sind.
Die Auswahlregeln gelten nicht bei anderen Prozessen,
etwa bei der Anregung von Atomen durch Stösse.
Atomspektrum 1: Termschema des Natriumatoms (links) im
Vergleich zu dem des Wasserstoffatoms (rechts). Die eingekreisten Zahlen sind
die Hauptquantenzahlen n.
Atomspektrum 2: Termschema des Calciumatoms. Ganz unten
steht der Anregungszustand des einen Valenzelektrons (4s, 3d), darüber befinden
sich die Zustände, die das zweite Valenzelektron einnimmt (ns, np).
Atomspektrum 3: Termschema des Quecksilberatoms. Die
eingekreisten Zahlen sind die Hauptquantenzahlen n.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.