Brennstoffzelle

Irene Kramer-Schwenk
Energiewandler mit hohem »Wirkungsgrad, der nach dem Prinzip der » Elektrolyse die chemische Energie eines Brennstoffes direkt in elektrische Energie umwandelt. Ihre Entwicklung für den praktischen Einsatz als »Gleichstromgenerator« (Gleichstrom) begann etwa Anfang der 60er Jahre. Kommerziell haben sich B. noch nicht eingeführt. Die verschiedenen B. typen unterscheiden sich hauptsächlich durch die verwendeten Elektrolyten und die durch diese vorgegebenen Betriebstemperaturen. Weit entwickelt sind u. a. sog. alkalische B. (Alkalische wässrige Lösungen wie Natronlauge färben rotes Lackmuspapier blau. ) mit Wasserstoff und Sauerstoff als Reaktionspartnern. Beide Gase werden durch großflächige Elektroden in den vom Elektrolyten (Elektrolyse) durchströmten Reaktionsraum gepumpt; Sauerstoff passiert die Kathode, Wasserstoff die Anode, als Elektrolyt dient eine Lauge (Alkalien). Die bei dem Prozeß reagierenden Elektronen bzw. Ionen lassen einen Strom fließen, der durch Kontakte an Kathode und Anode über einen äußeren Kreis (Verbraucher) geleitet wird, der den Elektronenaustausch ermöglicht. B. können stationär oder z. B. als Energiequelle für Elektrofahrzeuge eingesetzt werden. BZ, Brennstoffelement, Knallgaszelle, FC (englisch für fuel cell), ein galvanisches Element, bei dem die Elektrodenmaterialien kontinuierlich zugeführt werden, wohingegen diese bei Primärelementen einmalig verbraucht und bei Sekundärelementen (Akkumulator) durch zeitlich getrennte Ladevorgänge regeneriert werden. Brennstoffzellen werden nach ihrer Betriebstemperatur unterschieden in Niedertemperatur-Aggregate ( < 100-200°C), Mitteltemperatur-Aggregate (ca. 100-600°C, z.B. phosphorsaure Brennstoffzellen) und Hochtemperaturtemperatur-Aggregate ( > 500°C, z.B. Oxidkeramik-Brennstoffzellen). Ein Überblick über die wichtigsten Typen von Brennstoffzellen gibt die Tabelle.
Brennstoffzelle: Typen von
Brennstoffzellen (BZ).
|
Name und internationale Abkürzung |
Betriebstemp. |
Wirkungsgrad |
Elektrolyt |
Brennstoff (ausser O2) |
Anwendung |
|
alkalische BZ (alkaline fuel cell, AFC) |
80-90 |
50-65 |
Kalilauge (KOH) |
H2 |
Transport, Raumfahrt, Schiffahrt |
|
Polymer-Elektrolytmembran-BZ (PEMFC) |
80-90 |
50-60 |
Polymermembran (z.B. Nafion) |
H2, reformiertes Methan/ Methanol |
wie AFC, Elektroautos |
|
Phosphorsaure BZ (phosphoric acid fuel
cell, PAFC) |
200 |
35-45 |
Phosphorsäure (H3PO4, über 300°C:
HPO3) |
H2, reformiertes Methan |
Kraftwerke (1-100MW), Blockheizkraftwerke (50-500kW) |
|
Schmelzkarbonat-BZ (molten carbonate fuel
cell, MCFC) |
650 |
45-60 |
Calciumcarbonat (CaCO3) |
H2, Methan |
wie PAFC |
|
Oxidkeramik-/Festkeramik-BZ (solid oxide fuel
cell, SOFC) |
850-1000 |
50-60 |
Zirkonoxid (ZrO2) |
H2, Methan, Kohlegas |
wie PAFC |
Das Prinzip der Brennstoffzelle beruht darauf, dass bei einer
Redoxreaktion (z.B. ![]() I) die Dissoziations- oder Anodenreaktion (
I) die Dissoziations- oder Anodenreaktion (![]() , II) und die
Bildungs- oder Kathodenreaktion (
, II) und die
Bildungs- oder Kathodenreaktion (![]() , III) räumlich
getrennt ablaufen, wobei der Elektronenaustausch über einen externen Verbraucher
geleitet wird. Da der grösste Teil der Bildungsenthalpie (Bildungswärme) des H2O als elektrische
Energie und nicht als Wärme frei wird, spricht man auch von einer "kalten
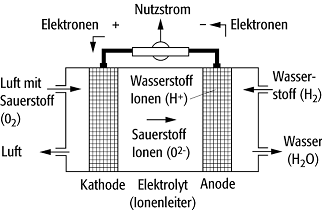
Verbrennung". Der Aufbau einer Brennstoffzelle (Abb. 1) besteht aus
zwei getrennten Brennstoffkammern, die über eine für Ionen permeable Schicht
(Ionenleiter) verbunden sind, welche für Elektronen und neutrale Gase
idealerweise nichtleitend ist. Die Elektroden stehen in gutem elektrischem
Kontakt mit dem Ionenleiter und befinden sich jeweils zwischen den
Brennstoffkammern und dem Ionenleiter. Die bei der Anodenreaktion freigesetzten
Ionen wandern durch den Ionenleiter und anschliessend durch die Kathode in die
kathodenseitige Brennkammer. Die Elektronen wandern gleichzeitig im externen
Kreis von der Anode zur Kathode, wobei sie Stromarbeit verrichten können.
, III) räumlich
getrennt ablaufen, wobei der Elektronenaustausch über einen externen Verbraucher
geleitet wird. Da der grösste Teil der Bildungsenthalpie (Bildungswärme) des H2O als elektrische
Energie und nicht als Wärme frei wird, spricht man auch von einer "kalten
Verbrennung". Der Aufbau einer Brennstoffzelle (Abb. 1) besteht aus
zwei getrennten Brennstoffkammern, die über eine für Ionen permeable Schicht
(Ionenleiter) verbunden sind, welche für Elektronen und neutrale Gase
idealerweise nichtleitend ist. Die Elektroden stehen in gutem elektrischem
Kontakt mit dem Ionenleiter und befinden sich jeweils zwischen den
Brennstoffkammern und dem Ionenleiter. Die bei der Anodenreaktion freigesetzten
Ionen wandern durch den Ionenleiter und anschliessend durch die Kathode in die
kathodenseitige Brennkammer. Die Elektronen wandern gleichzeitig im externen
Kreis von der Anode zur Kathode, wobei sie Stromarbeit verrichten können.
Bei der Berechnung des Wirkungsgrades einer Brennstoffzelle ist zu berücksichtigen, dass nicht die gesamte Bildungsenthalpie DH der Anodenreaktion für die Erzeugung elektrischer Energie zur Verfügung steht, sondern nur die Gibbssche Enthalpie DG = DH - TDS, da die Entropie S des Produkts der Bildungsreaktion geringer sein kann als die der Reaktanden, in diesem Fall wird die Wärme DQ = TDS frei (T: Reaktionstemperatur). Wirkungsgrad h = DG/DH = 1 - TDS/DH.
Bei der Umsetzung von CH4 und O2 zu CO2 und H2O ist DS = 0, also h = 1, bei der wichtigen Reaktion von H2 und O2 zu H2O ist dagegen DS = 44,4 kJ/(K × kmol). Um im Gesamtsystem DS = 0 zu erreichen, muss hier Wärme frei werden, diese Abwärme könnte allenfalls in Blockheizkraftwerken mitgenutzt werden, wodurch wieder h = 1 erreicht werden könnte (s. u.).
Die Zellspannung U0 (Leerlaufspannung) erhält man aus der Forderung,
dass die erzeugte elektrische Energie gleich DG sein muss,
d.h. ![]() (n: Zahl der umgesetzten Mole, NA: Avogadro-Konstante, F:
Faraday-Konstante). Bei Stromentnahme ist der "praktische"
Wirkungsgrad, das Verhältnis von Klemmenspannung unter Belastung und
theoretischer Leerlaufspannung, kleiner als der theoretische und abhängig von
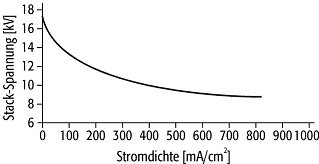
der Stromdichte (Abb. 2): Nach einem schnellen Abfall bei kleinen Stromdichten
gibt es bei mittleren Stromdichten einen quasilinearen Bereich, in dem der
ohmsche Widerstand des Elektrolyten und die begrenzte Reaktionsgeschwindigkeit
dominieren. Bei grossen Stromdichten ( > 800mA/cm2) fällt die Zellspannung
aufgrund der Diffusionshemmung ganz ab: Es können nicht mehr ausreichend
Reaktionspartner heran- und Reaktionsprodukte abgeführt werden.
(n: Zahl der umgesetzten Mole, NA: Avogadro-Konstante, F:
Faraday-Konstante). Bei Stromentnahme ist der "praktische"
Wirkungsgrad, das Verhältnis von Klemmenspannung unter Belastung und
theoretischer Leerlaufspannung, kleiner als der theoretische und abhängig von
der Stromdichte (Abb. 2): Nach einem schnellen Abfall bei kleinen Stromdichten
gibt es bei mittleren Stromdichten einen quasilinearen Bereich, in dem der
ohmsche Widerstand des Elektrolyten und die begrenzte Reaktionsgeschwindigkeit
dominieren. Bei grossen Stromdichten ( > 800mA/cm2) fällt die Zellspannung
aufgrund der Diffusionshemmung ganz ab: Es können nicht mehr ausreichend
Reaktionspartner heran- und Reaktionsprodukte abgeführt werden.
Der auf den Einsatz an Primärenergie bezogene Wirkungsgrad von Brennstoffzellen ist deutlich grösser als bei der Stromerzeugung durch Kraft-Wärme-Kopplung in Verbrennungs- oder Kernkraftwerken. Brennstoffzellen können eine wichtige Rolle als Bindeglied zwischen konventionellen und erneuerbaren Formen der Energienutzung spielen. Besonders interessant ist dabei die Erzeugung von molekularem Wasserstoff durch Solarenergie (solare Wasserstoffwirtschaft). Ein grosser Nachteil dieses Verfahrens ist jedoch der dann erforderliche weiträumige Transport bzw. die Lagerung von hochexplosivem Wasserstoffgas. Eine andere Möglichkeit besteht darin, Methan oder Methanol unter Ausnutzung der Abwärme von Hochtemperatur-Brennstoffzellen katalytisch in Wasserstoff und CO2 umzuwandeln (Reformierung), bei Methanol z.B. nach der Gleichung CH3OH + H2OÛ3H2 + CO2. Der Nachteil des zusätzlichen Energieaufwands wird dadurch aufgewogen, dass Methanol als Flüssigkeit aufgrund der im Vergleich zu H + -Gas unter Normalbedingungen fast 104-mal grösseren Dichte wesentlich leichter und sicherer zu transportieren ist, was vor allem für den Einsatz im Strassenverkehr von Vorteil ist. Ausserdem kann Methanol effizient aus Erdgas oder Kohlegas gewonnen werden, in Zukunft wahrscheinlich auch aus Biomasse (regenerative Energien). Ausser der Brennstoffversorgung besteht die grösste technische Schwierigkeit im Auffinden von Werkstoffen, die beständig gegenüber den z.T. sehr hohen Betriebstemperaturen und der Korrosion durch Sauerstoff, Wasserstoff und Wasserdampf sind.
Das Prinzip der Brennstoffzelle wurde bereits 1839 von dem englischen Physiker W. Grove zusammen mit der thermischen Zersetzung von Wasserdampf entdeckt. Die Entdeckung des elektrodynamischen Prinzips (Erzeugung von elektrischer Energie mit Gleichstromgeneratoren bzw. Wechselstromgeneratoren) durch W. v. Siemens drängte die elektrochemische Energieerzeugung jedoch zunächst in den Hintergrund. In der Folge erlangten nur Batterien und Akkumulatoren technische Bedeutung. Erst für die Bordenergieversorgung in Raumfahrzeugen und U-Booten wurde die Brennstoffzelle in den sechziger Jahren wiederentdeckt: Der erste Einsatz waren 1963 die Gemini-Missionen mit einer Stromversorgung durch Alkali-Brennstoffzellen (AFC), auch das Space Shuttle besitzt solche Zellen (drei unabhängige Brennstoffzellensysteme mit je 92kg bzw. 14kW). Dabei wird das "Abfallprodukt" H2O zur Wasserversorgung der Besatzung (ca. 7Liter/Stunde) verwendet. Der praktische Wirkungsgrad von modernen, in der Raumfahrt eingesetzten Brennstoffzellen konnte auf über 80% gesteigert werden.
Zukünftige Anwendungen der Brennstoffzelle liegen in der nachhaltigen Energieversorgung in der Solar-Wasserstoff-Kreislaufwirtschaft, als netzunabhängige Stromversorgung für Elektroautos und in Gross- und Blockheizkraftwerken, bei denen die Abwärme entweder als Fernwärme oder ebenfalls zur Stromgewinnung genutzt wird. [OP]
Brennstoffzelle 1: Bei der Umsetzung von Sauerstoff und Wasserstoff zu Wasser werden an der Anode Elektronen freigesetzt, die als nutzbarer Strom zur Kathode fliessen. Mit dem ionisierten Sauerstoff werden sie wieder zurücktransportiert.
Brennstoffzelle 2: Klemmenspannung in Abhängigkeit von der Stromdichte bei einer leistungsstarken Hochtemperatur-Brennstoffzelle mit dem typischen schnellen Abfall bei niedrigen Stromdichten und einem fast linearen Verlauf bei höheren.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.