chemische Bindung

Karl-Wilhelm Steinfieber
Zusammenhaltende Kräfte zwischen Atomen, Molekülen, Feststoffen und Gasen. Unterschieden werden drei Grundtypen, zu denen Übergangsformen hinzukommen: Ionenbindung (Ionen), Atombindung und Metallbindung. Die Metallbindung kommt zustande, wenn in einem Atomgitter (Kristall) die Atome ihre Valenzelektronen an eine gemeinsame Einheit abgeben. Die dadurch positiv geladenen Metallatome bilden ein stabiles Gitter. im engeren Sinn der durch verschiedenartige Bindungskräfte bewirkte Zusammenhalt von zwei oder mehreren Atomen bzw. Atomgruppen innerhalb von Molekülen sowie in kondensierter Materie. Im weiteren Sinn gehören zu den chemischen Bindungen auch die durch zwischenmolekulare Kräfte erzielten Wechselwirkungen zwischen gesättigten Molekülen. Sie werden nach der Grösse der Bindungsenergie in starke innermolekulare Hauptvalenzbindungen und in die durch zwischenmolekulare und schwach innermolekulare Wechselwirkung entstehenden Nebenvalenzbindungen unterschieden. Gelegentlich bezeichnet man als Nebenvalenzbindung nur diejenigen Bindungen, die durch eine gerichtete van-der-Waalssche Wechselwirkung mit Sättigungscharakter zustande kommt, z.B. die Wasserstoffbrückenbindung. In Hauptvalenzbindungen sind die Bindungsenergien grösser als 42 kJ/Mol, in Nebenvalenzbindungen kleiner als 42 kJ/Mol. Diese Unterscheidung ist nicht in allen Fällen streng gültig. Bei den Hauptvalenzbindungen unterscheidet man drei Grenzfälle: die heteropolare Bindung, die kovalente Bindung (mit ihrem Spezialfall der koordinativen Bindung) und die metallische Bindung.
Eine anschauliche Erklärung für die Bindungsbildung gibt die Oktett-Regel. Eine vollständige Erklärung ist nur möglich, wenn man neben elektrodynamischen auch quantenmechanische Prinzipien berücksichtigt. Danach erfolgt die zur Molekülbildung erforderliche Energieerniedrigung meistens durch eine Absenkung der kinetischen Energie infolge der Delokalisierung der an der Bindung beteiligten Elektronen (Bindungselektronen) innerhalb des Molekülgerüsts.
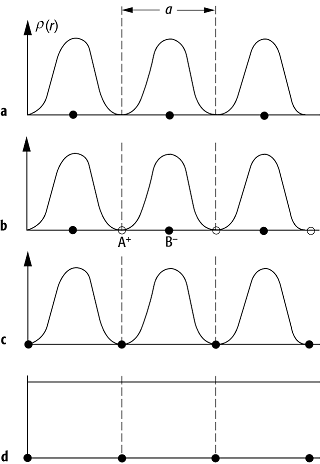
Die kovalente und die koordinative Bindung sind richtungsabhängig, während die ionische und die metallische Bindung isotrop sind, keinen Sättigungscharakter aufweisen und deswegen in der Regel dicht gepackte Strukturen (Kugelpackungen) begünstigen. Eine nützliche Charakterisierung der Bindungstypen liefert die schematische Dichteverteilung der Valenzelektronen (Abb. 1).
1) Die heteropolare Bindung (Ionenbindung, Elektrovalenz, elektrostatische Bindung, polare Bindung) beruht auf der Wirkung elektrostatischer Kräfte zwischen entgegengesetzt geladenen Ionen. Die meisten heteropolaren Bindungen entstehen zwischen Elementen entgegengesetzter Bereiche des Periodensystems. Typische Vertreter sind die salzartigen Verbindungen der anorganischen Chemie, vor allem die Alkalihalogenide. Sie bestehen aus einem metallischen Element, dessen Atome leicht ihre äusseren Elektronen abgeben, und einem nichtmetallischen Element, dessen Atome das Bestreben haben, zusätzliche Elektronen aufzunehmen. Die auf diese Weise gebildeten stabilen Kationen und Anionen treten zu einem stabilen Molekül oder einem Kristall zusammen, indem sie ihre Elektronenstruktur im wesentlichen beibehalten. In der organischen Chemie treten echte heteropolare Bindungen zum Beispiel bei den Salzen von Carbon- und Sulfonsäuren auf.
Voraussetzung zur Bildung heteropolarer Bindungen sind eine relativ kleine Ionisierungsenergie des Metallatoms und eine relativ grosse Elektronenaffinität des Nichtmetallatoms bzw. -radikals. Ist die Summe aus Elektronenaffinität und der bei der Zusammenführung der Ionen zum Ionengitter frei werdenden Coulombschen Anziehungsenergie grösser als die Ionisierungsenergie des Kationbildners, so findet ein Elektronenübergang vom Metallatom zum Nichtmetallatom statt, und es kommt zwischen den Ionen zur heteropolaren Bindung. Im Normalfall einer Reaktion, in der die Reaktionspartner im festen Aggregatzustand oder molekularen Gaszustand vorliegen, sind die Verdampfungs- oder Dissoziationswärmen der beteiligten Elemente zu berücksichtigen. Die gegenseitige Verknüpfung dieser Grössen erfolgt im Born-Haberschen Kreisprozess.
Abgesehen von den idealen Grenzfällen der heteropolaren Bindung, wie sie bei den typisch salzartigen Verbindungen, z.B. NaCI, KF, vorliegen, kommt es im allgemeinen bei Annäherung zweier entgegengesetzt geladener Ionen zu einer Deformation der Elektronenhülle, die die Elektronen des Anions so weit zum Kation hinüberzieht, dass sie dort freie Elektronenbahnen besetzen und sich damit den Verhältnissen bei der kovalenten Bindung nähern.
2) Die kovalente Bindung (homöopolare, unpolare Bindung, Atombindung,
Elektronenpaarbindung, Austauschbindung) kommt bei Verbindungen zwischen
Nichtmetallen, d.h. vorwiegend in den Verbindungen der organischen Chemie vor.
Am reinsten ausgebildet ist sie bei Gasmolekülen, die sich aus zwei gleichen
Atomen zusammensetzen. Die kovalente Bindung ist eine Folge der
Austauschwechselwirkung der Valenzelektronen der Bindungspartner. Nach der
klassischen Oktett-Theorie von Lewis wird die kovalente Bindung durch ein
Elektronenpaar vermittelt, das den beiden miteinander verbundenen Atomen
gemeinsam angehört. Dadurch entsteht eine der Edelgaskonfiguration
entsprechende Elektronenanordnung. Als Symbol der kovalenten Bindung werden der
Valenzstrich (z.B. ![]() ) oder die
Punktschreibweise (z.B.
) oder die
Punktschreibweise (z.B. ![]() ) verwendet.
Während an den Einfachbindungen nur ein Elektronenpaar beteiligt ist, werden
die Mehrfachbindungen durch mehrere gemeinsame Elektronenpaare gebildet. Zum
Verständnis dieser Erscheinungen müssen neben den s-Elektronen
(Sigma-Elektronen) noch p-Elektronen (Pi-Elektronen) angenommen werden.
Verbindungen mit Einfach- und Doppelbindungen in abwechselnder Folge heissen
konjugierte Verbindungen. Bei vielen Atomen werden die Valenzzustände durch
Mischung verschiedener Elektronenfunktionen gebildet (Hybridisation). Im
Unterschied zu den heteropolaren Bindungen sind die kovalenten Bindungen
gerichtet. Die Winkel zwischen zwei Bindungsrichtungen heissen Valenzwinkel.
) verwendet.
Während an den Einfachbindungen nur ein Elektronenpaar beteiligt ist, werden
die Mehrfachbindungen durch mehrere gemeinsame Elektronenpaare gebildet. Zum
Verständnis dieser Erscheinungen müssen neben den s-Elektronen
(Sigma-Elektronen) noch p-Elektronen (Pi-Elektronen) angenommen werden.
Verbindungen mit Einfach- und Doppelbindungen in abwechselnder Folge heissen
konjugierte Verbindungen. Bei vielen Atomen werden die Valenzzustände durch
Mischung verschiedener Elektronenfunktionen gebildet (Hybridisation). Im
Unterschied zu den heteropolaren Bindungen sind die kovalenten Bindungen
gerichtet. Die Winkel zwischen zwei Bindungsrichtungen heissen Valenzwinkel.
In Molekülen vom Typ AB mit ungleichen Atomen erhält die kovalente Bindung wegen der unterschiedlichen Elektronegativitäten polaren Charakter. Aber auch bei Molekülen aus gleichen Atomen, z.B. H2, Cl2, O2, ergibt ein Vergleich der errechneten mit den experimentell gefundenen Bindungsverhältnissen, dass neben der reinen unpolaren Bindung geringe Anteile einer polaren Bindung beteiligt sind (Abb. 3). Stoffe mit reiner kovalenter Bindung leiten den elektrischen Strom nicht. Ein weiteres charakteristisches Merkmal der kovalenten Bindung ist die Sättigung.
Kommt eine kovalente Bindung nur durch ein einziges, beiden
Bindungspartnern gemeinsames Elektron zustande, so liegt eine
Einelektronenbindung vor. Das einfachste Molekül mit einer solchen Bindung ist
das Wasserstoffmolekülion ![]() . Jedoch ist
die Einelektronenbindung im Wasserstoffmolekülion nur halb so fest wie die
Elektronenpaarbindung. Sie kommt durch Mesomerie der beiden Grenzstrukturen
. Jedoch ist
die Einelektronenbindung im Wasserstoffmolekülion nur halb so fest wie die
Elektronenpaarbindung. Sie kommt durch Mesomerie der beiden Grenzstrukturen ![]() zustande. Einelektronenbindungen sind nur dann
stabil, wenn die beiden verbundenen Atome identisch oder sehr ähnlich sind.
zustande. Einelektronenbindungen sind nur dann
stabil, wenn die beiden verbundenen Atome identisch oder sehr ähnlich sind.
Sind bei einer kovalenten Bindung anstelle eines Elektronenpaars drei Elektronen an der Bindung beteiligt, so spricht man von Dreielektronenbindung. Die Stabilität dieser Bindung beruht auf einer Mesomerie der Grenzstrukturen A: × B und A × :B. Die Dreielektronenbindung lässt sich durch das Symbol A × × × B darstellen. Ihre Bindungsenergie ist etwa halb so gross wie die einer Elektronenpaarbindung. Dreielektronenbindungen sind nur dann stabil, wenn die beiden Atome A und B identisch oder ihre Elektronegativitäten wenig voneinander verschieden sind.
Die semipolare Bindung (koordinative Bindung) ist ein
Spezialfall der kovalenten Bindung, bei der beide Elektronen des bindenden
Elektronenpaares von einem der beiden Bindungspartner stammen. Die gebundenen
Atome haben dadurch entgegengesetzte formale Ladungen: A: + B ![]() A:B. Schematisch lässt sich das Zustandekommen
einer semipolaren Bindung dadurch erklären, dass das Atom A ein Elektron an das
Atom B abgibt, so dass in beiden ein energetisch günstiges Atomorbital mit nur
einem Elektron besetzt ist. Damit sind die Voraussetzungen zur Bildung einer normalen
kovalenten Bindung gegeben.
A:B. Schematisch lässt sich das Zustandekommen
einer semipolaren Bindung dadurch erklären, dass das Atom A ein Elektron an das
Atom B abgibt, so dass in beiden ein energetisch günstiges Atomorbital mit nur
einem Elektron besetzt ist. Damit sind die Voraussetzungen zur Bildung einer normalen
kovalenten Bindung gegeben.
3) Die metallische Bindung ist der Bindungstyp von Metallen und Legierungen. Sie ist durch die im Metallgitter auftretenden quasifreien Elektronen (Elektronengasmodell) charakterisiert, die den Raum zwischen den positiven Ionen ausfüllen und diese zusammenhalten (Abb. 2). Aus den in Metallgittern nahezu immer auftretenden grossen Koordinationszahlen folgt, dass die Bindungen nicht von der Art der lokalisierten Bindungen sind, sondern dass ein extremer Fall von Bindungsdelokalisierung vorliegt. Die den Metallen und Legierungen eigenen wichtigsten Eigenschaften, z.B. grosses elektrisches und thermisches Leitvermögen sowie ihre Plastizität, sind direkt eine Folge dieser in den Metallen vorliegenden Bindungsart.
Die quantitative Beschreibung der chemischen Bindung in Molekülen, Clustern und Festkörpern geht heute durchweg von quantenmechanischen Modellen aus. Historisch wichtige Näherungsverfahren zur kovalenten Bindung beispielsweise sind unter der Bezeichnung VB-(Valence-Bond)-Methode und LCAO (Linear Combination of Atomic Orbitals) bekannt. Moderne Betrachtungen der chemischen Bindung basieren auf der Molekülorbitaltheorie (MO-Theorie) bzw. dem Bändermodell im Fall kristalliner Festkörper und berücksichtigen, soweit erforderlich, die Vielteilcheneffekte nachträglich durch Störungsrechnung, Konfigurationsentwicklungen (Quantenchemie) oder nichtlokale Austausch-Korrelations-Funktionale (Dichtefunktionaltheorie).
chemische Bindung 1: Schematische Dichteverteilung der Valenzelektronen für die verschiedenen Bindungstypen; a bezeichnet die Gitterkonstante. a) Van-der-Waals-Bindung: die Elektronen bleiben an den Atomen lokalisiert; b) ionische Bindung: die Valenzelektronen befinden sich vollständig am Anion B - ; c) kovalente Bindung: die Valenzelektronen befinden sich im Bindungsbereich zwischen den Atomen; d) metallische Bindung: die Valenzelektronendichte ist konstant und über das gesamte Metall delokalisiert.
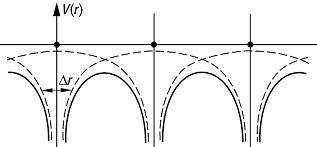
chemische Bindung 2: Schema eines Molekül- oder Kristallpotentials (durchgezogene Linie) als Ergebnis der Überlagerung atomarer Potentiale (gestrichelt). Dr ist ein Mass für die Ortsunschärfe eines atomaren Elektrons.
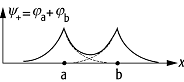
chemische Bindung 3: Oben: Durch Überlappung der
Wellenfunktionen ja
und jb
des Elektrons, das sich im Feld des Kerns a und des Kerns b bewegt, erhöht sich
die Aufenthaltswahrscheinlichkeit zwischen den beiden Kernen; unten:
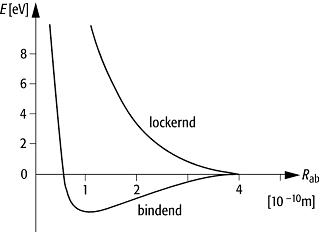
Energiekurven des Wasserstoffmolekülions ![]() in Abhängigkeit vom Kernabstand rab
für den bindenden und den lockernden Zustand, unter Berücksichtigung der
Coulombschen Abstossung zwischen den beiden Kernen.
in Abhängigkeit vom Kernabstand rab
für den bindenden und den lockernden Zustand, unter Berücksichtigung der
Coulombschen Abstossung zwischen den beiden Kernen.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.