Bindungsindex

Hermann Loring
Verallgemeinerung des ursprünglich für zweiatomige Moleküle eingeführten Bindungsgrades, der dort die Zahl der Elektronenpaare bezeichnet, die an einer Bindung beteiligt sind. Dieser Begriff kann in die Molekülorbitaltheorie integriert werden, wenn man einem einfach besetzten, bindenden (antibindenden) Molekülorbital den Bindungsgrad + 1/2 ( - 1/2) und einem nichtbindenden den Bindungsgrad 0 zuordnet. Für die leichtesten homonuklearen zweiatomigen Moleküle ergeben sich dann die in der Tabelle angegebenen ganzzahligen Werte.
| bottom:solid black 1.1pt;border-right:
none;mso-border-top-alt:solid black .75pt;mso-border-left-alt:solid black .75pt;
mso-border-bottom-alt:solid black 1.1pt;padding:0cm 3.55pt 0cm 3.55pt\'>
Molekül |
bottom:solid black 1.1pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.1pt;
padding:0cm 3.55pt 0cm 3.55pt\'>
H-H |
bottom:solid black 1.1pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.1pt;
padding:0cm 3.55pt 0cm 3.55pt\'>
Li-Li |
bottom:solid black 1.1pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.1pt;
padding:0cm 3.55pt 0cm 3.55pt\'>
NºN |
bottom:solid black 1.1pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.1pt;
padding:0cm 3.55pt 0cm 3.55pt\'>
O=O |
bottom:solid black 1.1pt;border-right:solid black 1.0pt;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.1pt;
mso-border-right-alt:solid black .75pt;padding:0cm 3.55pt 0cm 3.55pt\'>
F-F |
|
Bindungsgrad |
1 |
1 |
3 |
2 |
1 |
|
Bindungsindex |
1,00 |
1,00 |
3,00 |
2,00 |
1,00 |
| bottom:solid black 1.0pt;border-right:none;mso-border-left-alt:solid black .75pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 3.55pt 0cm 3.55pt\'>
De [eV] |
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 3.55pt 0cm 3.55pt\'>
4,75 |
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 3.55pt 0cm 3.55pt\'>
1,07 |
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 3.55pt 0cm 3.55pt\'>
9,91 |
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 3.55pt 0cm 3.55pt\'>
5,23 |
bottom:solid black 1.0pt;border-right:solid black 1.0pt;mso-border-bottom-alt:
solid black .75pt;mso-border-right-alt:solid black .75pt;padding:0cm 3.55pt 0cm 3.55pt\'>
1,67 |
Auf mehratomige Moleküle ist diese Definition nicht ohne
weiteres übertragbar, da die Molekülorbitale i.a. über alle Atome delokalisiert
sind. Legt man jedoch die Darstellung eines Molekülorbitals yk(r)
als Linearkombination von Atomorbitalen ![]() zugrunde,
zugrunde,
![]()
wobei i die Orbitale am Atom A abzählt, kann man einen Bindungsindex bAB zwischen den Atomen A und B definieren durch
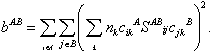
Hierbei bezeichnen nk die Besetzungszahl des k-ten
Molekülorbitals und ![]() die Überlappintegrale. Diese Definition ist
auf beliebige Moleküle mit abgeschlossenen Schalen anwendbar, wobei der so
berechnete Bindungsindex zwar i.a. keine ganze Zahl mehr ist, jedoch für
Systeme, die durch lokalisierte Elektronenpaarbindungen beschrieben werden
können, Zahlenwerte liefert, die nahe bei dem (ganzzahligen) Bindungsgrad
liegen. Delokalisierte Bindungen, wie sie in aromatischen oder metallischen
Verbindungen vorliegen, sind dann daran zu erkennen, dass der Bindungsindex
deutlich verschieden von der nächsten benachbarten ganzen Zahl ist. Mit Hilfe
des Bindungsindexes kann man für den Begriff der Bindigkeit eine Verallgemeinerung
VA
definieren durch:
die Überlappintegrale. Diese Definition ist
auf beliebige Moleküle mit abgeschlossenen Schalen anwendbar, wobei der so
berechnete Bindungsindex zwar i.a. keine ganze Zahl mehr ist, jedoch für
Systeme, die durch lokalisierte Elektronenpaarbindungen beschrieben werden
können, Zahlenwerte liefert, die nahe bei dem (ganzzahligen) Bindungsgrad
liegen. Delokalisierte Bindungen, wie sie in aromatischen oder metallischen
Verbindungen vorliegen, sind dann daran zu erkennen, dass der Bindungsindex
deutlich verschieden von der nächsten benachbarten ganzen Zahl ist. Mit Hilfe
des Bindungsindexes kann man für den Begriff der Bindigkeit eine Verallgemeinerung
VA
definieren durch:
![]()
die i.a. ebenfalls auf nicht ganzzahlige Werte führt. Es muss allerdings betont werden, dass die Beschreibung der elektronischen Struktur von Molekülen durch Bindungsindex und Bindigkeit ähnlich wie die durch Valenzstrichformeln rein formalen Charakter hat, d.h. sie sagt weder über die tatsächliche Stärke einer Bindung etwas aus, wie die in der Tabelle angegebenen Bindungsenergien De zeigen, noch über die tatsächliche Elektronendichteverteilung. Innerhalb einer Serie verschiedener Verbindungen derselben Atome wie den Kohlenwasserstoffen ermöglicht sie allerdings vergleichende Aussagen, die oft qualitative Zusammenhänge zutreffend wiedergeben. [MG1]
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.