Elektronenzustände zweiatomiger Moleküle

Irene Kramer-Schwenk
Atom- und Molekülphysik,
Energieeigenzustände der Elektronen in einem zweiatomigen Molekül, die sich
durch die Wechselwirkung von Elektronenbewegung und Molekülrotation ergeben.
Die Elektronen besetzen im Grundzustand die Molekülorbitale mit der niedrigsten
Energie, wobei jedes Orbital höchstens zwei Elektronen besitzt (Pauli-Prinzip).
Entartete Orbitale werden zunächst einfach mit paralleler Spinanordnung belegt
(Hundsche Regel). Die Einzeldrehimpulse li
der äussersten Elektronen in unabgesättigten Schalen sind zum gesamten
Bahndrehimpuls L gekoppelt. Dessen Quantenzahl L
in Bezug auf die Kernverbindungslinie kennzeichnet die Gesamtzustände einer
gegebenen Elektronenkonfiguration (S, P, L
... für L
= 0, 1, 2
...). Die Spins der Elektronen koppeln zu einem Gesamtspin ![]() , der infolge magnetischer Spin-Bahn-Kopplung
(Hüllendrehimpuls W) die Multiplizität (2S
+ 1)
bestimmt. Bei zwei Elektronen kann S = 1 und S = 0 und die Multiplizität 3 und 1 sein, d.h. es gibt Triplett-
und Singulettzustände. Der gesamte Drehimpuls J des
Moleküls ergibt sich aus der Wechselwirkung
des Drehimpulses der Rotation N mit dem
Hüllendrehimpuls W: W + N = J.
, der infolge magnetischer Spin-Bahn-Kopplung
(Hüllendrehimpuls W) die Multiplizität (2S
+ 1)
bestimmt. Bei zwei Elektronen kann S = 1 und S = 0 und die Multiplizität 3 und 1 sein, d.h. es gibt Triplett-
und Singulettzustände. Der gesamte Drehimpuls J des
Moleküls ergibt sich aus der Wechselwirkung
des Drehimpulses der Rotation N mit dem
Hüllendrehimpuls W: W + N = J.
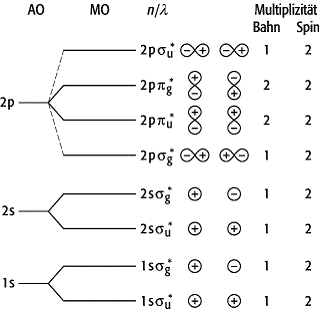
Elektronenzustände zweiatomiger Moleküle 1: Durch
Linearkombination der Atomorbitale AO entstehen Molekülorbitale MO, die durch
die Quantenzahlen n (Hauptquantenzahl des AO), l (Drehimpulsquantenzahl des AO) und ![]() (magnetische
Quantenzahl) charakterisiert sind.
(magnetische
Quantenzahl) charakterisiert sind.
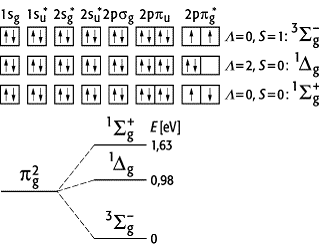
Elektronenzustände zweiatomiger Moleküle 2: Mögliche Konfigurationen der beiden äussersten Elektronen im O2-Molekül. Hierbei ist L die Quantenzahl des Bahndrehimpulses in Richtung der Kernverbindungslinie, S die Gesamtspinquantenzahl, S und D die Gesamtzustände der Elektronen für L = 0 und L = 2; die Indizes g und u kennzeichnen Molekülorbitale, die durch symmetrische und unsymmetrische Linearkombination gebildet werden.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.