Katalyse

Julian Schultheiss
Beschleunigung einer chemischen Reaktion durch die Hinzugabe eines bestimmten Stoffes (Katalysator). Liegen Ausgangsstoffe und Katalysator in gleichem Aggregatzustand (z.B. flüssig/flüssig oder gasförmig/gasförmig) vor, so spricht man von homogener Katalyse, unterscheiden sie sich (z.B.gasförmig/fest), von heterogener Katalyse.
Die Ursache der Katalyse ist, dass die Aktivierungsenergie der Reaktion in Gegenwart eines Katalysators herabgesetzt wird. Der Katalysator ermöglicht einen anderen Reaktionsweg (siehe Abb.), so dass der langsame, geschwindigkeitsbestimmende Schritt der nicht katalysierten Reaktion vermieden wird. Im Endeffekt erzielt man eine höhere Reaktionsgeschwindigkeit bei derselben Temperatur. Während eine Temperaturerhöhung von jeweils 10 °C nur eine Geschwindigkeitserhöhung der Reaktion um den Faktor 2-4 bewirkt (bei exothermen Reaktionen nimmt dabei zudem die Produktausbeute ab), kann die Zugabe eines geeigneten Katalysators die Reaktion bis auf das Millionenfache beschleunigen.
Ein dem Reaktionsgemisch zugesetzter Stoff kann auch verzögernd wirken. Man spricht dann von negativer Katalyse, Antikatalyse oder Inhibition; der Katalysator wirkt dabei als Inhibitor.
Bei der Autokatalyse bildet sich der Katalysator erst während des Prozesses. Zum Beispiel wird die säurekatalysierte Halogenierung des Acetons durch die bei der Reaktion entstehenden Protonen autokatalytisch beschleunigt.
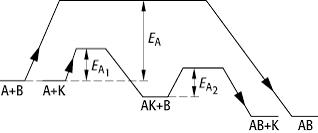
Katalyse: Gesamtreaktion: A + B ![]() AB, Aktivierungsenergie EA.
Reaktionsschema mit Katalysator: A + K
AB, Aktivierungsenergie EA.
Reaktionsschema mit Katalysator: A + K ![]() AK, Aktivierungsenergie
AK, Aktivierungsenergie ![]() ; AK + B
; AK + B ![]() AB + K, Aktivierungsenergie
AB + K, Aktivierungsenergie ![]() ;
; ![]() .
.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.