Salzschmelzen

Petra Nordinghaus-Martin
Festkörperphysik, durch Schmelzen von Ionenkristallen (z.B. NaCl) erzeugte Elektrolyte. Durch Erhöhung der kinetischen Energie der Ionen, d.h. Erwärmung des Kristalls, werden die Bindungskräfte zwischen den Ionen so weit gelockert, dass zu den Schwingungsfreiheitsgraden ein für Flüssigkeiten charakteristischer Translationsfreiheitsgrad hinzukommt. Die Eigenschaften der frei beweglichen Anionen und Kationen werden weitgehend von interionischen Wechselwirkungen langer Reichweite bestimmt. Daher unterscheiden sie sich stark von gewöhnlichen Flüssigkeiten.
Die beim Schmelzen eines Ionenkristalls eintretende Zunahme des Molvolumens und die Abnahme der Durchschnittskoordinationszahl werden durch ein Anwachsen bereits im Kristall vorhandener Leerstellen verursacht. Jedoch kommt es durch die auch in der Schmelze wirksam bleibenden starken Coulomb-Kräfte zu einer Nahordnung derart, dass die Abstände zwischen An- und Kationen kleiner, die mittleren Abstände zwischen gleichgeladenen Ionen grösser werden als im Festkristall.
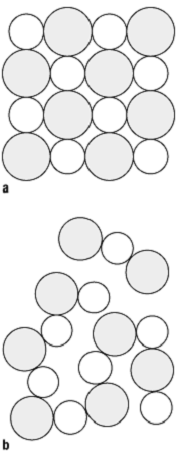
Salzschmelzen: Aufbau einer Ionenschmelze (schematisch). Ionenradienverhältnis 1 : 1,4.
a) Ionengitter des Festkristalls; b) Struktur der Ionenschmelze (»Momentaufnahme«, Gitteraufweitung etwas übertrieben).
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.