vant Hoffsche Gleichungen

Manfred Schönborn
vant Hoffsche Gleichungen
1) Osmose: Abhängigkeit des osmotischen Drucks ideal verdünnter Lösungen von Nichtelektrolyten von der Konzentration der Lösung. Getrennt durch eine semipermeable Membran befindet sich das reine Lösungsmittel A beim Druck p auf der einen Seite im Gleichgewicht mit A als Mischungskomponente mit dem Druck (p + P) auf der anderen Seite der Membran. Das chemische Potential ist auf beiden Seiten der Membran gleich gross: mA (xA, p + P) = mA*(p + P) + RT ln xA, wobei mA* das chemische Potential des reinen Lösungsmittel und xA der Molenbruch des Lösungsmittels in der Lösung bedeuten. Unter Berücksichtigung der Druckabhängigkeit der freien Enthalpie erhält man die Gleichung
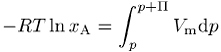
mit Vm als molarem Volumen des reinen Lösungsmittels. Für stark verdünnte Lösungen (xA ® 1; Molenbruch des gelösten Stoffs xB » nB / nA; nAVm = V) folgt daraus die vant-Hoffsche Gleichung: PV = nBRT. Diese ähnelt der Zustandsgleichung eines idealen Gases (ideale Gasgleichung). Setzt man die Konzentration des gelösten Stoffs cB = nB / V in die Gleichung ein, vereinfacht sich diese zu P = cBRT. Der osmotische Druck hängt demnach bei konstanter Temperatur nur von der Konzentration des gelösten Stoffs ab.
2) chemische Reaktionskinetik: Beschreibung der Abhängigkeit der Gleichgewichtskonstanten Kc (Massenwirkungskonstante, Massenwirkungsgesetz) von der Temperatur T. Die Gleichung lautet bei konstantem Druck (Reaktionsisobare)
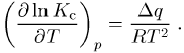
Hierbei
ist qp die frei werdende
Wärme einer exothermen bzw. die zuzuführende Wärme einer endothermen Reaktion
bei konstantem Druck p und gleich der
Enthalpieänderung Dh. Im Falle konstanten Volumens
(Reaktionsisochore) wird sie durch
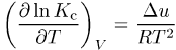
gegeben, wobei Du die Änderung der inneren Energie ist. Wird hingegen die Temperatur konstant gehalten, dann ist
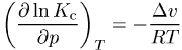
mit der Volumenänderung Dv.
3) Abhängigkeit der Gefrierpunktserniedrigung bzw. Siedepunktserhöhung DT stark verdünnter Lösungen von der Konzentration der Lösung:
![]()
Hierbei ist TA der Gefrier- bzw. Siedepunkt des reinen Lösungsmittels, xB der Molenbruch des gelösten Stoffes und DhA die molare Schmelz- bzw. Verdampfungsenthalpie des reinen Lösungsmittels.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.