Aminosäure

Julian Schultheiss
Aminocarbonsäure, Carbonsäuren mit einer oder mehreren Aminogruppen. Man spricht von a-Aminosäuren, wenn die Aminogruppe am Kohlenstoff sitzt, welches der Carboxylgruppe benachbart ist. Entsprechend bezeichnet man die Verbindung als b-, g-, ... Aminosäure, wenn ein, zwei, ... Kohlenstoffatome dazwischen liegen. Bis auf ganz wenige Ausnahmen sind Aminosäuren wasserlöslich. Sie haben einen pH-Wert zwischen pH4 und pH9 und liegen als Zwitterionen vor.
In der Natur wurden mehr als 260 verschiedene Aminosäuren nachgewiesen. Besondere Bedeutung haben 20 sogenannte proteinogene a-Aminosäuren, die Monomere der Proteine (Abbildung, Tabelle). Mit Ausnahme des Glycin ist das a-Kohlenstoffatom dieser Aminosäuren chiral, biologische Bedeutung hat nur die sogenannte L-Form des asymmetrischen Zentrums. Schaut man vom Wasserstoff entlang der H-Ca Bindung auf das Kohlenstoffatom, so sind die Aminogruppe, die Carboxylgruppe und die Seitenkette in dieser Reihenfolge im entgegengesetzten Uhrzeigersinn um das Ca-Atom angeordnet. Die Reihenfolge der Aminosäuren in der Polypeptidkette des Proteins wird durch die Reihenfolge der Kodone in der DNS bestimmt. Jeder proteinogenen Aminosäure entsprechen ein oder mehrere Kodone. Bei der Translation werden die Aminosäuren zuerst in Aminoacyl-Adenylsäuren umgewandelt und mit einer passenden Transport-RNS verbunden, um danach auf dem Ribosom in der durch Boten-RNS überbrachten Kodon-Reihenfolge ins Protein eingebaut zu werden.
Aminosäure: Die 20 proteinogenen Aminosäuren mit ihren physikalischen Eigenschaften. Die Polarität wird halbquantitativ durch die Zahl der Sterne ausgedrückt. Die Zeilen -NH2 und -COOH beziehen sich auf alle Aminosäuren. Wasser ist zum Vergleich aufgeführt.
| bottom:solid black 1.5pt;border-right:
none;mso-border-top-alt:solid black .75pt;mso-border-left-alt:solid black .75pt;
mso-border-bottom-alt:solid black 1.5pt;padding:0cm 0cm 0cm 0cm\'>
Typ |
bottom:solid black 1.5pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.5pt;
padding:0cm 0cm 0cm 0cm\'>
1-Code |
bottom:solid black 1.5pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.5pt;
padding:0cm 0cm 0cm 0cm\'>
3-Code |
bottom:solid black 1.5pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.5pt;
padding:0cm 0cm 0cm 0cm\'>
Molekular- |
bottom:solid black 1.5pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.5pt;
padding:0cm 0cm 0cm 0cm\'>
Titrations-punkt pKa |
bottom:solid black 1.5pt;border-right:none;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.5pt;
padding:0cm 0cm 0cm 0cm\'>
Extinktions- koeffizient eM (280 nm) [M-1cm-1] |
bottom:solid black 1.5pt;border-right:solid black 1.0pt;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.5pt;
mso-border-right-alt:solid black .75pt;padding:0cm 0cm 0cm 0cm\'>
Polarität |
|
Alanin |
A |
Ala |
89,09 |
|
|
* |
|
Cysteine |
C |
Cys |
121,16 |
10,28 |
120 |
* |
|
Asparaginsäure |
D |
Asp |
132,10 |
3,65 |
|
*** |
|
Glutaminsäure |
E |
Glu |
146,13 |
4,25 |
|
*** |
|
Phenylalanin |
F |
Phe |
165,19 |
|
|
* |
|
Glycin |
G |
Gly |
75,07 |
|
|
* |
|
Histidin |
H |
His |
155,16 |
6,00 |
|
*** |
|
Isoleucin |
I |
Ile |
131,17 |
|
|
* |
|
Lysin |
K |
Lys |
147,19 |
10,53 |
|
*** |
|
Leucin |
L |
Leu |
131,17 |
|
|
* |
|
Methionin |
M |
Met |
149,21 |
|
|
* |
|
Asparagin |
N |
Asn |
132,12 |
|
|
** |
|
Prolin |
P |
Pro |
115,13 |
|
|
* |
|
Glutamin |
Q |
Gln |
146,15 |
|
|
** |
|
Arginin |
R |
Arg |
175,20 |
12,48 |
|
*** |
|
Serin |
S |
Ser |
105,20 |
|
|
** |
|
Threonin |
T |
Thr |
119,02 |
|
|
** |
|
Valin |
V |
Val |
117,15 |
|
|
* |
|
Tryptophan |
W |
Trp |
204,22 |
|
5690 |
* |
|
Tyrosin |
Y |
Tyr |
181,19 |
10,07 |
1280 |
** |
|
Wasser |
|
|
18,01 |
|
|
** |
|
-NH2 |
|
|
|
8,56 |
|
*** |
| bottom:solid black 1.0pt;border-right:none;
mso-border-left-alt:solid black .75pt;mso-border-bottom-alt:solid black .75pt;
padding:0cm 0cm 0cm 0cm\'>
-COOH |
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 0cm 0cm 0cm\'>
|
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 0cm 0cm 0cm\'>
|
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 0cm 0cm 0cm\'>
|
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 0cm 0cm 0cm\'>
3,56 |
bottom:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;padding:0cm 0cm 0cm 0cm\'>
|
bottom:solid black 1.0pt;border-right:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;mso-border-right-alt:solid black .75pt;
padding:0cm 0cm 0cm 0cm\'>
*** |
Nach ihren physikalischen Eigenschaften werden die proteinogenen Aminosäuren klassifiziert in:
- neutrale Aminosäuren (ohne geladene Gruppe in der Seitenkette) und geladene Aminosäuren (mit Ladung in der Seitenkette); letztere unterteilen sich in saure (negative Ladung, Asparaginsäure und Glutaminsäure) und basische (positive Ladung, Arginin, Histidin, Lysin) Aminosäuren;
- hydrophobe (oder apolare) Aminosäuren (Alanin, Glycin, Isoleucin, Leucin, Methionin, Phenylalanin, Prolin, Tryptophan, Valin) und hydrophile (oder polare) Aminosäuren;
- aromatische (Histidin, Phenylalanin, Tyrosin, Tryptophan) und nichtaromatische Aminosäuren.
Die aromatischen Aminosäuren zeigen frei oder im gebundenen Zustand (z.B. im Protein) eine charakteristische UV-Absorption (Absorptionsspektroskopie) bei etwa 280 nm (Tabelle). In geringerem Umfang gilt dies auch für Disulphidbrücken, welche von zwei Cysteinen ausgebildet werden kann. Nicht alle Lebewesen können die gesamte Palette der Aminosäuren de novo synthetisieren. So sind Menschen und Tiere auf die Zufuhr der essentiellen Aminosäuren (Arginin, Histidin, Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan und Valin) über die Nahrung angewiesen.
Mehrere Aminosäuren (Glycin, Alanin, Glutatmat, Valin und Prolin) wurden im Innern des Merchison-Meteoriten gefunden, was als Beweis für die extraterristrische und wahrscheinlich abiogene Bildung von Aminosäuren angesehen wird. [FE]
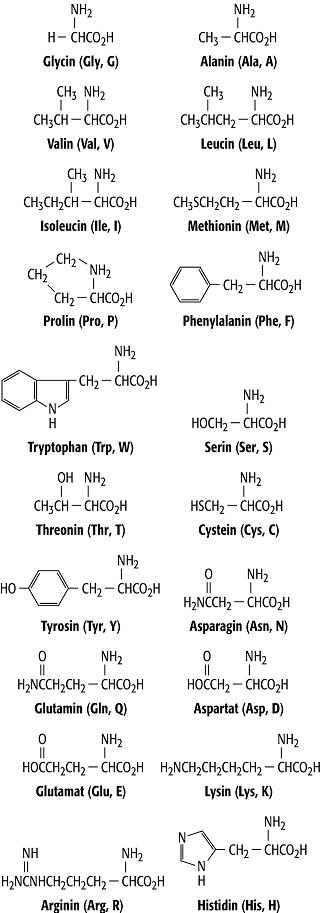
Aminosäure: Die 20 proteinogenen Aminosäuren, ihre Trivialnamen und ihre Drei- und Einbuchstabencodes.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.