Adsorption

Hermann Loring
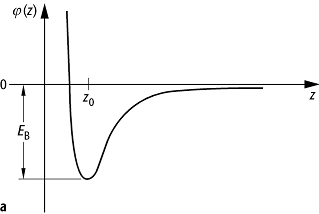
Eine spezielle »Sorption«, d. h. ein Vorgang, bei dem ein Stoff durch einen mit ihm in Berührung kommenden selektiv aufgenommen wird (s. auch Absorption). Unter A. versteht man die Anreicherung eines Stoffes an der Grenzfläche zweier Phasen, was technisch vor allem an A. flächen fest/flüssig und fest/gasförmig genutzt wird. Aktivkohle- und Zigarettenfilter z. B. adsorbieren Giftstoffe. Feste A. schichten mit einer gewissen Porigkeit zur Aufnahme von Molekülen, Ionen, oder Kolloiden sowie Seifen und synthetische Waschmittel, die den Zusammenhalt der Moleküle einer Wasseroberfläche lockern, bezeichnet man als »grenzflächenaktiv«. Gewisse Stoffe, wie Silikagel (besonders aufbereitete kolloidale Kieselsäure) und Zeolithe (Gruppe natürlicher und synthetisch hergestellter Silikate, d. h. Salze von Kieselsäuren), eignen sich auch als Wärmespeicher. Beim Trocknen nehmen sie A. wärme auf, die beim Durchleiten kalter und feuchter Luft, die dadurch getrocknet und erwärmt wird, wieder extrahiert wird (Desorption). Die »innere Oberfläche« einer Handvoll Zeolith entspricht der Fläche von 20 Fußballfeldern. Adsorbentien wie Silikagel und Zeolithe werden zum Trocknen von Gasen und anderen Stoffen, zur Rückgewinnung von Lösungsmitteln etc. eingesetzt. Zeoüthe haben in Waschmitteln die Phosphate zur Wasserenthärtung (Wasserhärte) weitgehend ersetzt. Anlagerung von Atomen oder Molekülen an einer Oberfläche. Wichtig ist hierbei die chemische Reaktivität der Oberfläche, die durch die Existenz unabgesättigter Bindungen (kovalente Bindung), bzw. elektrostatischer Kräfte (ionische Bindung) geprägt ist. Je nach Art der Bindungskräfte unterscheidet man zwischen Chemisorption und Physisorption. Bei der Physisorption bleiben die elektronischen Strukturen von Adsorbat und Oberfläche weitgehend unverändert. Die wirkenden Kräfte sind schwach und mit den Van-der-Waals-Kräften in Molekülen vergleichbar, d.h. auf Dipol- oder Multipolwechselwirkungen zurückzuführen. Typische Bindungsenergien für physisorbierte Spezies liegen im Bereich von 10 bis 100 meV. Bei der Chemisorption wechselwirkt das Teilchen mit den unabgesättigten Valenzen der Oberfläche, was zu einer Veränderung der elektronischen Strukturen von Adsorbat und Oberfläche führt und i.A. die Austrittsarbeit des Festkörpers verändert. Typische Bindungsenergien von chemisorbierten Spezies liegen bei einigen Elektronenvolt. Bei der dissoziativen Adsorption zerfällt ein Molekül beim Adsorptionsprozess. Dieser kann dann als Kombination von Physisorption des Moleküls und nachfolgender Chemisorption einzelner Molekülbestandteile beschrieben werden. Der zugehörige Potentialverlauf ist am Beispiel der Chemisorption von Wasserstoff auf einer Metalloberfläche in der Abb. gezeigt. Die Wechselwirkung zwischen adsorbiertem Material und Material in der Gasphase beschreibt die Adsorptionskinetik. Wichtige Grössen sind der Haftkoeffizient, also das Verhältnis der Zahl der adsorbierten Teilchen zur Zahl der auftreffenden Teilchen, der Bedeckungsgrad, also der Quotient aus der Anzahl der besetzten und der Anzahl der vorhandenen Adsorptionsstellen, die Adsorptionsrate, also die Zahl der pro Zeiteinheit adsorbierten Teilchen, der Bedeckungsgrad, also der Quotient aus der Anzahl der besetzten und der Anzahl der vorhandenen Adsorptionsstellen und die Adsorptionsisotherme, die den Zusammenhang zwischen Bedeckungsgrad und Dampfdruck beschreibt. Zur Beschreibung der Adsorption gibt es verschiedene, nach ihren Entwicklern benannte Modelle bzw. Isotherme (Adsorptionsisotherme). Zur experimentellen Untersuchung der Adsorption werden u.a. LEED, UPS, XPS, AES und EELS eingesetzt. Zu den Anwendungen der Adsorption gehören die Trocknung mit Hilfe von Kieselgel und die Adsorptionschromatographie (Chromatographie).
Adsorption und Absorption sollten nicht miteinander verwechselt werden. [BK2, URE]
character:line-break\'>
character:line-break\'>
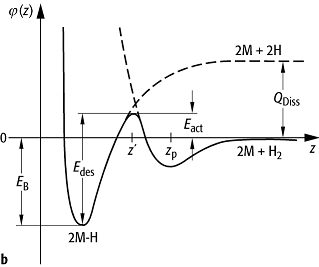
Adsorption: (a) Schema eines Chemisorptionspotentials als Funktion des Abstandes des adsorbierenden Teilchens von der Oberfläche. Der Gleichgewichtsabstand (z0) liegt im Bereich von 1 bis 3 Å, die Bindungsenergien (EB) um ein Elektronvolt. (b) zeigt die Kombination von Physisorptions- und Chemisorptionspotential am Beispiel der dissoziativen Wasserstoffadsorption (H2) auf Metallen (M). Die Aktivierungsenergie (Eact) zur Chemisorption eines H-Atoms aus dem physisorbierten Zustand ist geringer als die Dissoziationsenergie (QDiss) zur Zerlegung eines H2-Moleküls in der Gasphase.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.