Infrarot-Spektroskopie

Karl-Wilhelm Steinfieber
Festkörperphysik, IR-Spektroskopie, Ultrarot-Spektroskopie, UR-Spektroskopie, Teilgebiet der Spektroskopie, das elektromagnetische Strahlung aus dem infraroten Spektralbereich für die Untersuchung von festen, flüssigen oder gasförmigen Proben benutzt. Wenn eine geeignete Probe mit Infrarot-Strahlung durchstrahlt wird, so wird eine Reihe von Frequenzen dieser Infrarot-Strahlung absorbiert, die andere wird durchgelassen. Die absorbierten Frequenzen erlauben die Untersuchung der Energiezustände von Molekül-spezifischen Rotationen und Schwingungen (im Kristall Gitterschwingungen oder Phononen). Die Transmission oder Absorption einer Probe in Abhängigkeit von der Wellenzahl oder der Wellenlänge bezeichnet man als Infrarot-Spektrum, wobei das Spektrum eine eindeutige Identifikation der untersuchten Probe darstellt. Die Infrarot-Spektroskopie hat ihre Anwendungen in der qualitativen und quantitativen Analyse im wesentlichen in der Chemie (Strukturaufklärung, Identifizierung von Substanzen), aber auch in den Materialwissenschaften, der Festkörperhysik (Untersuchung von Gitterabsorptionen, Analyse optischer Eigenschaften etc.) und der Atmosphärenphysik (Messung atmosphärischer Spurenstoffe).
Die Schwingungen der Atome in einem Molekül oder Kristall um ihren Gleichgewichtsabstand lassen sich näherungsweise durch die Gesetze der klassischen Physik beschreiben (Abb. 2). Ein Molekül aus N Atomen hat 3 N Freiheitsgrade der Bewegung. Davon fallen 3 Freiheitsgrade auf die Translation und 3 weitere (bei nichtlinearen Molekülen) auf die Rotation, so dass 3 N - 6 Schwingungsfreiheitsgerade verbleiben. Ist die Probe hingegen ein Kristall, so entfallen im allgemeinen die Rotationsfreiheitsgrade und es bleiben 3 N - 3 Schwingungsfreiheitsgrade. Die Anzahl der Schwingungsfreiheitsgrade entspricht dabei der Anzahl der Eigenschwingungen (Gitterschwingungen) eines Moleküls oder Kristalls. Die theoretisch mögliche Anzahl von Schwingungen werden allerdings im Infrarot-Spektrum nicht beobachtet. Es gelten bestimmte Auswahlregeln: Infrarotes Licht wird nur von infrarot aktiven Molekülen absorbiert. Infrarot inaktive Schwingungen können häufig mit Hilfe der Raman-Spektroskopie gemessen werden. Schwingungen, die sowohl infrarot als auch raman inaktiv (raman aktiv) sind, können durch Neutronenstreuung untersucht werden. Gruppentheoretische (Gruppe) Betrachtungen erlauben schon im Vorfeld zu bestimmen, welche Schwingungen mit welcher Technik messbar sind. Eine weitere Vereinfachung von Infrarot-Spektren kann dadurch auftreten, dass bestimmte Schwingungen entartet sind, d.h. sie die gleiche Frequenz haben, aber in verschiedene Raumrichtungen erfolgen, z.B. beim CO2--Molekül.
Obwohl reale Modelle nur näherungsweise als harmonische Oszillatoren beschrieben werden können, erlaubt diese erste Näherung eine qualitative Betrachtung: je kleiner die Masse der beteiligten Atome ist, desto höher ist die Schwingungsfrequenz. Reale Modelle können nur näherungsweise als harmonische Oszillatoren betrachtet werden. Eine physikalisch korrekte, allerdings mathematisch aufwendigere Betrachtung der Infrarot-Spektroskopie ist nur mit Hilfe der Quantenmechanik und dem Modell eines anharmonischen Oszillators möglich.Anwendung in der Biophysik: Die Infrarot-Spektroskopie wird in der molekularen Biophysik zur Untersuchung der Struktur und der Hydratation von Biomakromolekülen genutzt. Allerdings sind IR-Spektren aus verschiedenen Gründen in der Praxis weniger wertvoll als Absoptionslinien im sichtbaren und UV-Bereich (Absorptionsspektroskopie): 1. Die Extinktionskoeffizienten für Nukleinsäuren im IR-Bereich sind z.B. um den Faktor zehn kleiner als im UV-Bereich. 2. Die IR-Linien liegen im Bereich der IR-Absorption des Wassers. Der Einsatz von D2O statt H2O umgeht dieses Problem nur teilweise. Die Absorptionslinien können in der Regel den Schwingungübergängen einzelner chemischer Bindungen bzw. wohldefinierter Atomgruppen zugeordnet werden. Z.B. sind die Amid-Bänder I und II, die zur Peptidgruppe von Aminosäuren gehören, deutliche Indikatoren der im Protein vorliegenden Sekundärstruktur. Wasserstoffbrücken zwischen polaren Gruppen von Biomakromolekülen mit D2O aus der Lösung verändern die Frequenz des Schwingungsüberganges der betroffen Atomgruppen und eignen sich daher, die Wasserzugänglichkeit und das Wasseradsorptionsverhalten dieser Atomgruppen zu messen.
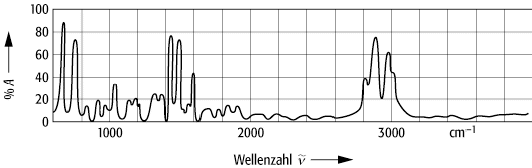
Infrarot-Spektroskopie 1: IR-Spektrum von Polystyrol.
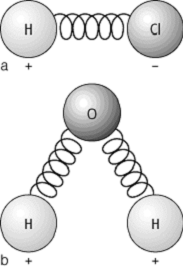
Infrarot-Spektroskopie 2: Mechanische Molekülmodelle.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.